U2. LA MATERIA Y SUS ESTADOS.
1. PROPIEDADES DE LA MATERIA.
La materia se caracteriza por una serie de propiedaes, que son de dos tipos: propiedades generales y propiedades específicas.
PROPIEDADES GENERALES.
Son comunes a toda la materia. Son las propiedades que presenta cualquier tipo de sustancia, como la masa y el volumen. La masa es la cantidad de sustancia que tiene un cuerpo. La unidad de masa en nel Sistema Internacional es el kg. El volumen es el espacio que ocupado por un cuerpo. La unidad de volumen en el Sistema Internacional es el m3.
RECUERDA:
PROPIEDADES CARACTERÍSTICAS O ESPECÍFICAS.
Son las propias de cada tipo de sustancia, de tal modo que a través de ellas se pueden identificar dichas sustancias. Por ejemplo, la densidad y las temperaturas de fusión y de ebullición
2. LA DENSIDAD.
La densidad de un cuerpo es una propiedad específica que se define como la masa que contiene cada unidad de volumen y se expresa según la fórmula:
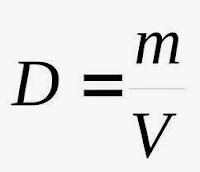 |
EJERCICIO 1. La masa de un trozo de metal es de 620 g; su volumen es de 250 mL. Calcula su densidad.
EJERCICIO 2. Si la leche tiene una densidad de 1,020 g/mL ¿Qué masa tendrá la leche contenida en un vaso de 250 mL?
EJERCICIO 3. La densidad del oro es de 19 g/mL. ¿Qué volumen ocupará un lingote de oro de 500 g?
Cualquier sustancia se puede presentar en tres estados físicos o estados de agregación: sólido, liquido y gaseoso.
3.1. SOLIDOS.
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas.
EJERCICIO 4. Mira la simulación anterior. Copia en tu cuaderono y tacha los que no proceda. En el estado sólido las partículas se mueven (libremente/vibrando). Y se disponen de forma (ordenada/desordenada) dando luga a restrusturas cristalinas. Al aumentar la temperatura, el movimiento (aumenta/disminuye)
3.2. LÍQUIDOS.
Los líquidos, al igual que los sólidos, tienen volumen constante. No tienen forma fija y adoptan la forma del recipiente que los contiene.
En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas.
EJERCICIO 5. Mira la simulación anterior. Copia en tu cuaderono y tacha los que no proceda. En el estado líquido las partículas (pueden trslacarse con libertad/vibran en torno a un punto fijo). Al aumentar la temperatura, el movimiento (aumenta/disminuye)
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
EJERCICIO 6. Mira la simulación anterior. Copia en tu cuaderono y tacha los que no proceda. En el estado gaseoso las partículas se mueven (casi libremente/libremente). Y se disponen de forma (ordenada/desordenada). Al aumentar la temperatura, el movimiento (aumenta/disminuye) y ( el número de choques contra las paredes del recipiente (aumenta/disminuye) y, por tanto, la presión (aumenta/disminuye).
EJERCICIO 7. Completa en tu cuaderno la siguiente tabla
| Propiedades | SÓLIDO | LÍQUIDO | GAS |
| Forma | |||
| Volumen | |||
| Compresibilidad | |||
| Pueden fluir |
4. LOS CAMBIOS DE ESTADO.
Cuando un cuerpo, por acción del calor o del frío pasa de un estado a otro, decimos que ha cambiado de estado.
En el caso del agua: cuando hace calor, el hielo se derrite y si calentamos agua líquida vemos que se evapora. El resto de las sustancias también puede cambiar de estado si se modifican las condiciones en que se encuentran. Además de la temperatura, también la presión influye en el estado en que se encuentran las sustancias.
Si se calienta un sólido, llega un momento en que se transforma en líquido. Este proceso recibe el nombre de fusión. El punto de fusión es la temperatura que debe alcanzar una sustancia sólida para fundirse. Cada sustancia posee un punto de fusión característico. Por ejemplo, el punto de fusión del agua pura es 0 °C a la presión atmosférica normal.
Si calentamos un líquido, se transforma en gas. Este proceso recibe el nombre de vaporización. Cuando la vaporización tiene lugar en toda la masa de líquido, formándose burbujas de vapor en su interior, se denomina ebullición. También la temperatura de ebullición es característica de cada sustancia y se denomina punto de ebullición. El punto de ebullición del agua es 100 °C a la presión atmosférica normal.
Durante todo el proceso de fusión del hielo la temperatura se mantiene constante. En la superficie del líquido se da el proceso de vaporización, algunas partículas tienen la suficiente energía para escapar. Si la temperatura aumenta, el número de partículas que se escapan es mayor, es decir, el líquido se evapora más rápidamente.
Cuando la temperatura del líquido alcanza el punto de ebullición, la velocidad con que se mueven las partículas es tan alta que el proceso de vaporización, además de darse en la superficie, se produce en cualquier punto del interior, formándose las típicas burbujas de vapor de agua, que suben a la superficie. En este punto la energía comunicada por la llama se invierte en lanzar a las partículas al estado gaseoso, y la temperatura del líquido no cambia (100ºC).
EJERCICIO 8. . Completa el texto siguiente: Al calentar un sólido se transforma en líquido; este cambio de estado se denomina . El punto de fusión es la a la que ocurre dicho proceso. Al subir la temperatura de un líquido se alcanza un punto en el que se forman burbujas de vapor en su interior, es el punto de ; en ese punto la temperatura del líquido permanece .
ESQUEMA QUE RESUME LOS CAMBIOS DE ESTADO.
EJERCICIO 9.
La temperatura a la que se transforma un sólido en líquido no se mantiene constante mientras dura la transformación si las sustancia es pura.
Un gas puede pasar directamente a sólido-
Un gas no tiene ni forma ni volumen fijos-
No existen fuerzas entre las partículas que constituyen un gas.
Un sólido tiene forma variable y volumen fijo-
El paso de gas a líquido recibe el nombre de condensación-
Un líquido tiene forma variable y volumen fijo
EJERCICIO 10. Si disminuimos el volumen del gas manteniendo constante la temperatura, las partículas chocan con (1)__________ (más / menos) frecuencia contra las paredes del recipiente que las contiene: (2)__________ (aumenta / disminuye) la presión sobre las paredes del recipiente
Si enfríamos el gas manteniendo constante el volumen, (3)__________ (aumentará / disminuirá) la energía cinética media y las partículas del gas chocaran con menos (más / menos) intensidad contra las paredes: (4)__________ (aumenta / disminuye) la presión del recipiente que contiene el gas.
Si enfríamos el gas manteniendo constante el volumen, (3)__________ (aumentará / disminuirá) la energía cinética media y las partículas del gas chocaran con menos (más / menos) intensidad contra las paredes: (4)__________ (aumenta / disminuye) la presión del recipiente que contiene el gas.
5. LAS LEYES DE LOS GASES.
1. El volumen disminuye al aumentar la presión. Ley de Boyle.
2. El volumen aumneta con la temperatura. Ley de Charles y Gay-Lussac.
3. La presión aumenta con la temperatura. Ley de Charles y Gay-Lussac.
Estas tres leyes dan lugar a la ecuación general de los gases:
Manejando esta ecuación, podemos deducir las otras.
LEY DE BOYLE.
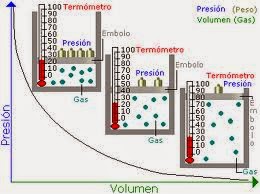 |
| VER: LEY DE BOYLE. |
EJERCICIO 11. Si 4.0 L de un gas están sometidos a 600.0 mmHg de presión., ¿cuál será su nuevo volumen si aumentamos la presión hasta 800.0 mmHg?.
LEY DE CHARLES.
 |
| VER: LEY DE CHARLES |
LEY DE GAY-LUSSAC.
 |
| VER: LEY DE GAY-LUSSAC |
EJERCICIO 13. Cierto volumen de un gas se encuentra a una presión de 970 mmHg cuando su temperatura es de 25.0°C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
EJERCICIO 14. En el interior de una jeringuilla hay de 10 cm3 de aire a 700 mm de Hg de presión y a temperatura ambiente de 20 ºC. Calcula el volumen que ocuparía dicha masa de aire en le interior de la jeringuilla si la presión fuera de 760 mm y la temperatura de 40º C.










Este comentario ha sido eliminado por el autor.
ResponderEliminar